Caso del mes julio 2023
« Todos los casos
Caso del mes julio 2023
Descripción
Autores
- Ana María Rambla ([email protected])
- Esther Martín Ramírez
- Isabel Herrera Herrera
- Irene Garrido Morro
- Juan Guzmán de Villoria. Hospital General Universitario Gregorio Marañón
Historia Clínica
Leyendas

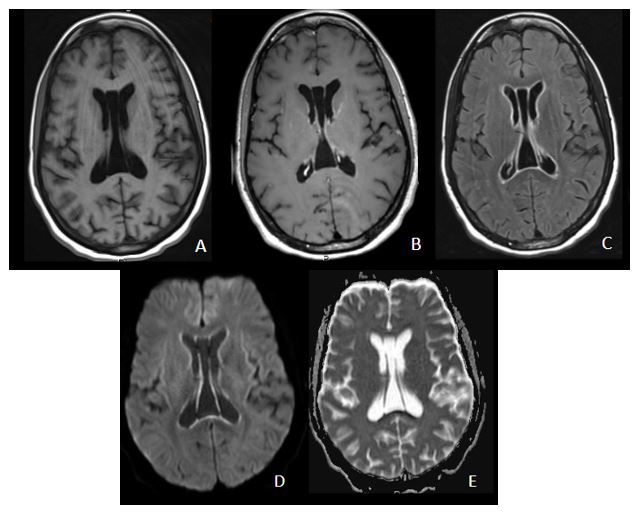
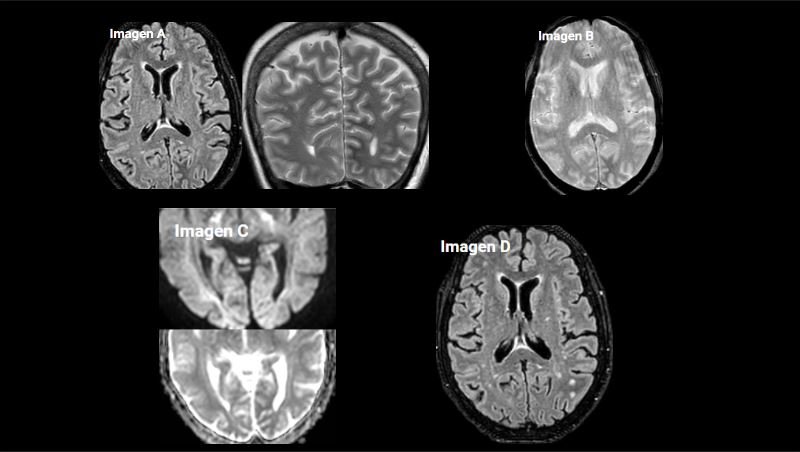
Figura 1 Imagen a: secuencia T1 con contraste axial Imagen b: secuencia FLAIR axial
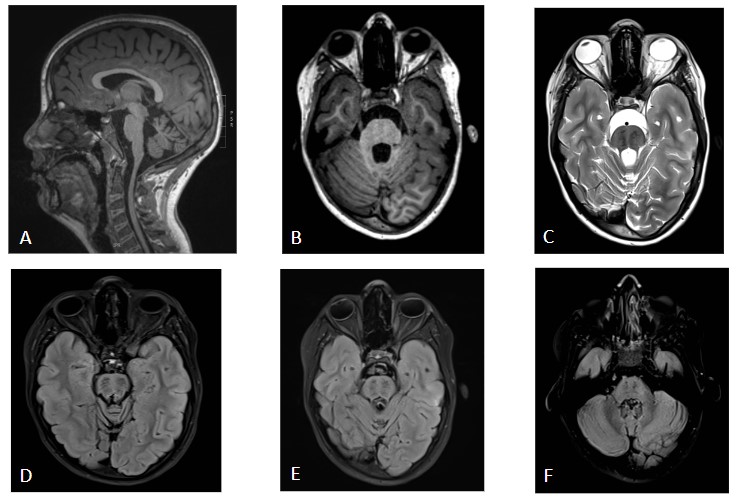
Imagen c: secuencia T2 coronal Leve ampliación de cisternas de la base craneal, con algún septo, especialmente en la cisterna perimesencefálica y ambiens en el lado derecho con leve distorsión de estructuras encefálicas próximas. No existe realce leptomeníngeo tras la administración de gadolinio. En el T2 coronal se aprecia hidrocefalia supratentorial con edema transependimario y borramiento generalizado de los surcos de la convexidad hemisférica.
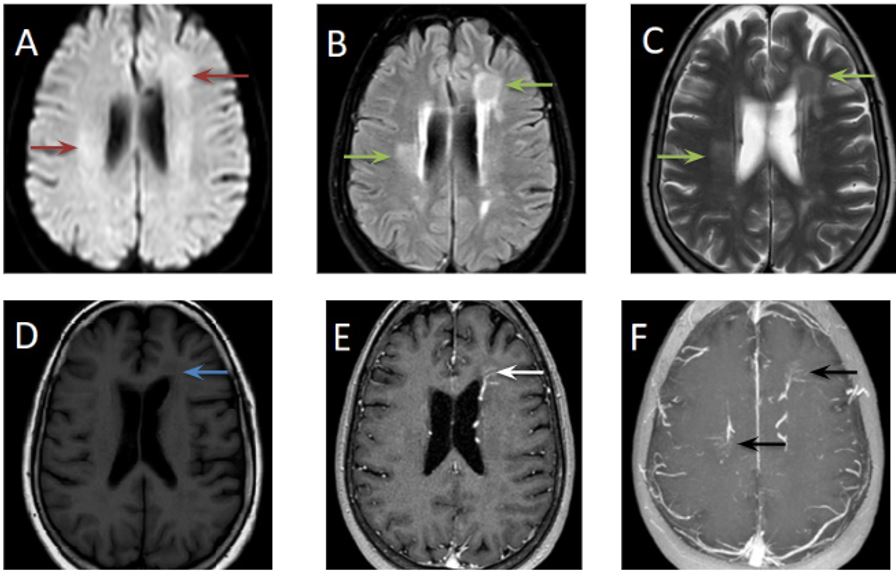
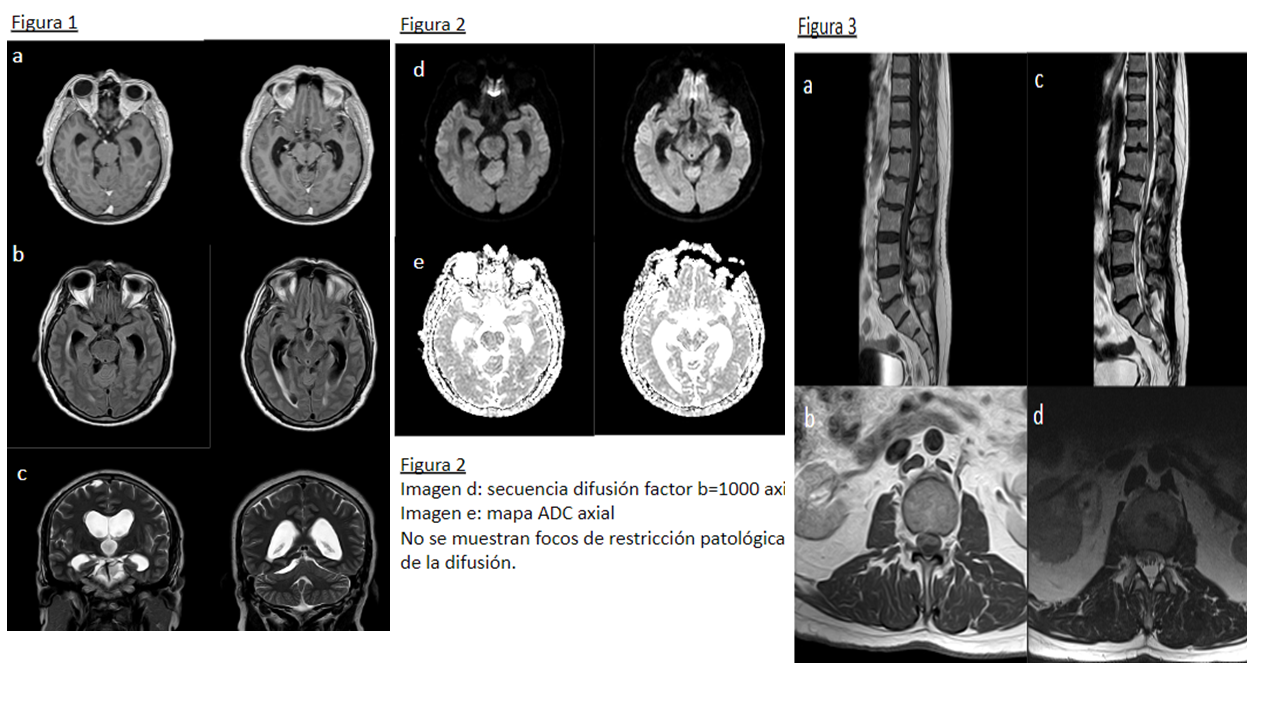
Figura 2 Imagen d: secuencia difusión factor b=1000 axial Imagen e: mapa ADC axial No se demuestran focos de restricción patológica de la difusión.
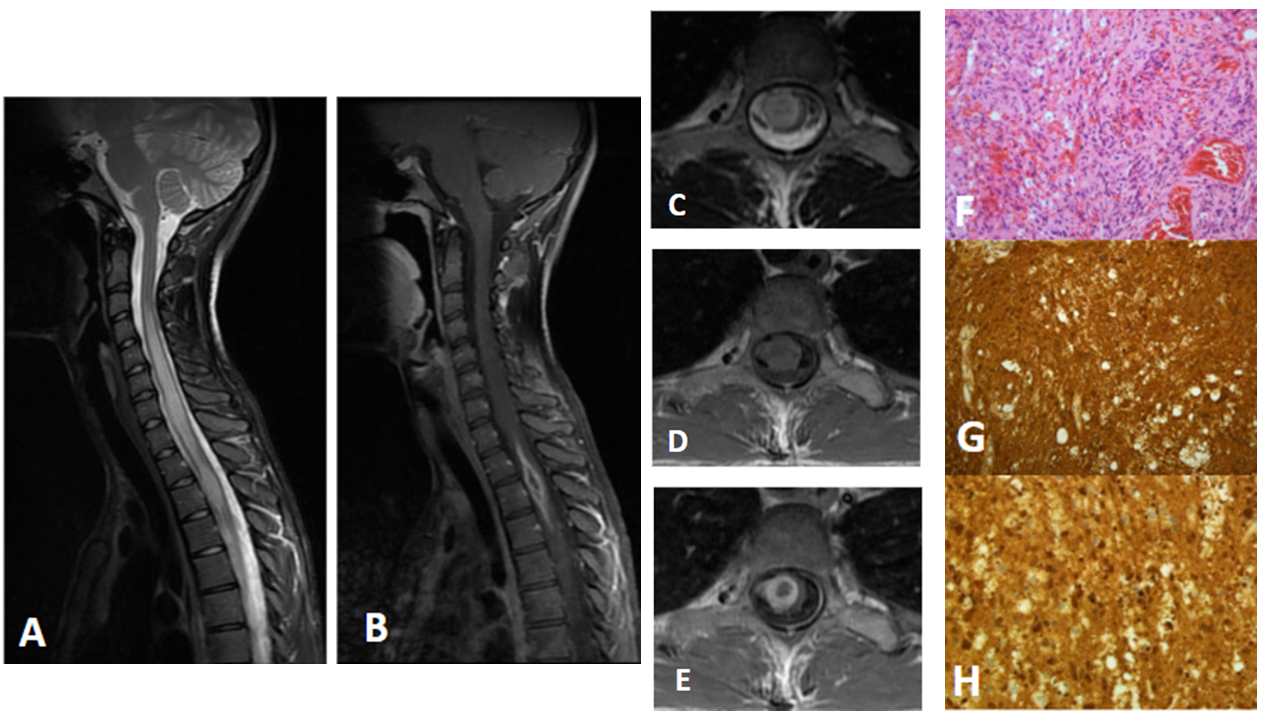
Figura 3 Imagen a: secuencia T1 con contraste sagital Imagen b: secuencia T1 con contraste axial Imagen c: secuencia T2 sagital Imagen d: secuencia T2 axial Las raíces de la cola de caballo se encuentran engrosadas y agrupadas en el centro del saco tecal, con distorsión de su contorno y nodularidad de la superficie, que muestra realce tras la administración de gadolinio.
Diagnóstico
Diagnóstico.
NEUROCISTICERCOSIS ARACNOIDEA (VARIANTE RACEMOSA)
Infección parasitaria más frecuente del SNC causada por la forma larvaria de la tenia Taenia Solium. Es endémica en determinados países de Sudamérica, Asia y Africa. La transmisión es por contaminación feco-oral por ingestión de los huevos del parásito. En el cerebro se presenta de dos formas: quistes parenquimatosos y extraparenquimatosos o racemosos (variante a la que nos referimos en este caso).
En la variante extraparenquimatosa o racemosa aparecen quistes subaracnoideos en “racimo de uvas”, variante que surge de la segmentación de los cisticercos con aparición de nuevos quistes que se expanden gradualmente con la degeneración del escólex y macroscópicamente aparecen como crecimientos anormales de membranas quísticas sin escólex que se expanden por espacios subaracnoideos. El proceso reactivo asociado puede causar meningitis o arteritis.
La presentación clínica de los quistes racemosos es pleomórfica y más agresiva que la parenquimatosa siendo el diagnóstico clínico complicado y por tanto la neuroimagen el pilar fundamental. Puede presentarse como episodios de hidrocefalia aguda por obstrucción de la vía del LCR, enfermedad cerebrovascular (infarto, AIT o hemorragia) secundaria a arteritis o meningitis generalizada. La afectación de la médula espinal se produce por extensión de la enfermedad subaracnoidea cerebral al espacio subaracnoideo espinal.
Los hallazgos en RM incluyen: 1) múltiples quistes extraaxiales, algunos de ellos de aspecto racemoso, similar al LCR en T1 y T2 y sin restricción patológica a la difusión. Pueden causar efecto de masa y edema circundante, 2) en algunos casos se evidencia realce leptomeníngeo secundario a aracnoiditis, 3)arteritis con o sin infarto.
Diagnóstico diferencial: incluye meningitis carcinomatosa y granulomatosa (sarcoidosis, tuberculosis, hongos). Otros diagnósticos diferenciales: quiste del plexo coroideo, quiste ependimario, quiste coloidal. En la neurocisticercosis espinal el diagnóstico diferencial incluye lesiones quísticas de origen parasitario, congénito o postraumático así como causas inflamatorias, infecciosas y tumorales.
Tratamiento: incluye agentes cisticidas, corticoesteroides y antiepilépticos. En algunos casos es necesario la derivación como tratamiento de la hidrocefalia.