Caso del mes julio
« Todos los casos
Caso del mes julio
Descripción
Autores
Catelani, Bárbara Teresa, Paula Sobral Viñas, Eloísa Santos Armentia, Silva Priegue Noelia.
Hospital Ribera Povisa. Vigo, Pontevedra, España.
Mail: [email protected]
Historia Clínica
Mujer de 71 años que refiere lumbalgia de 6 meses de evolución, más intensa al realizar actividad física moderada. Sin antecedente traumático, sin irradiación a miembros inferiores.
En la exploración física muestra Lasegue y Bragard negativo. Fuerza y sensibilidad conservada en miembros inferiores
Leyendas
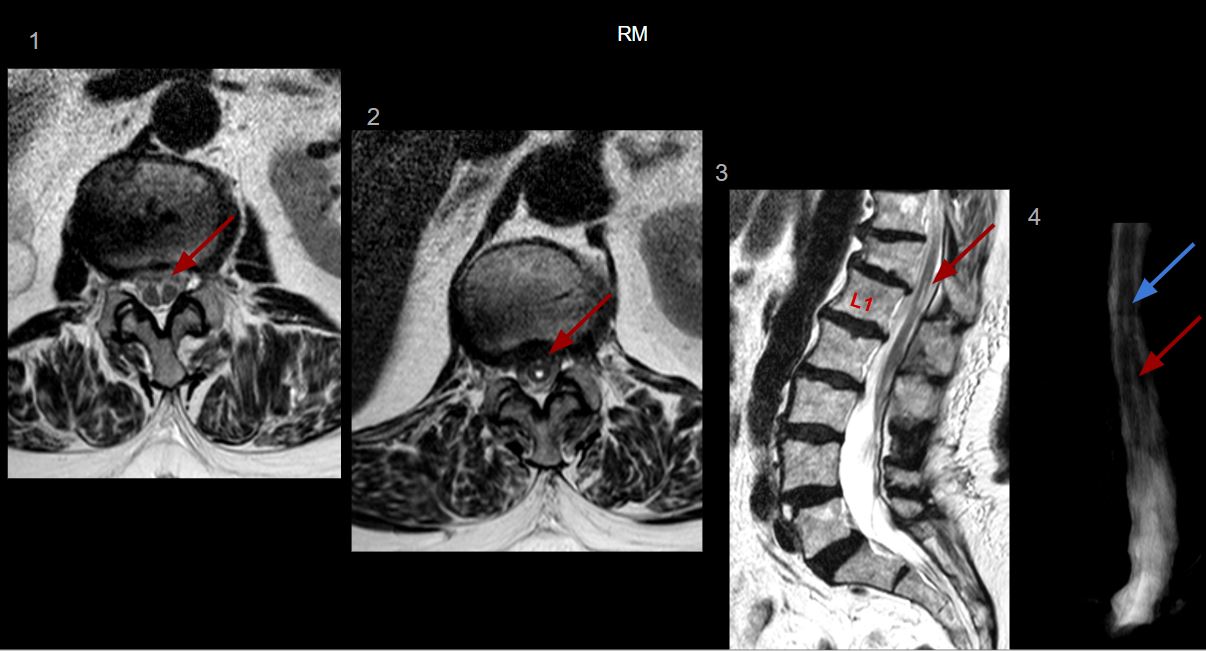
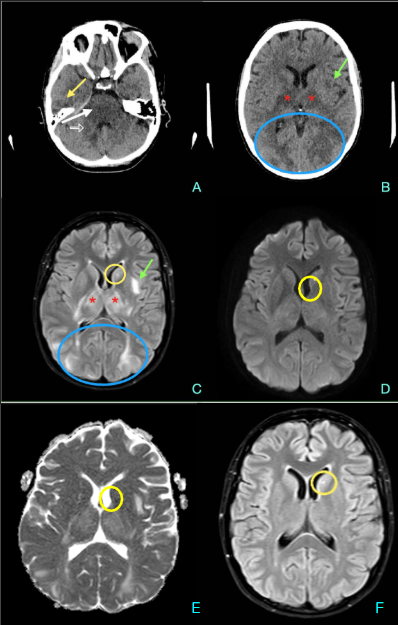
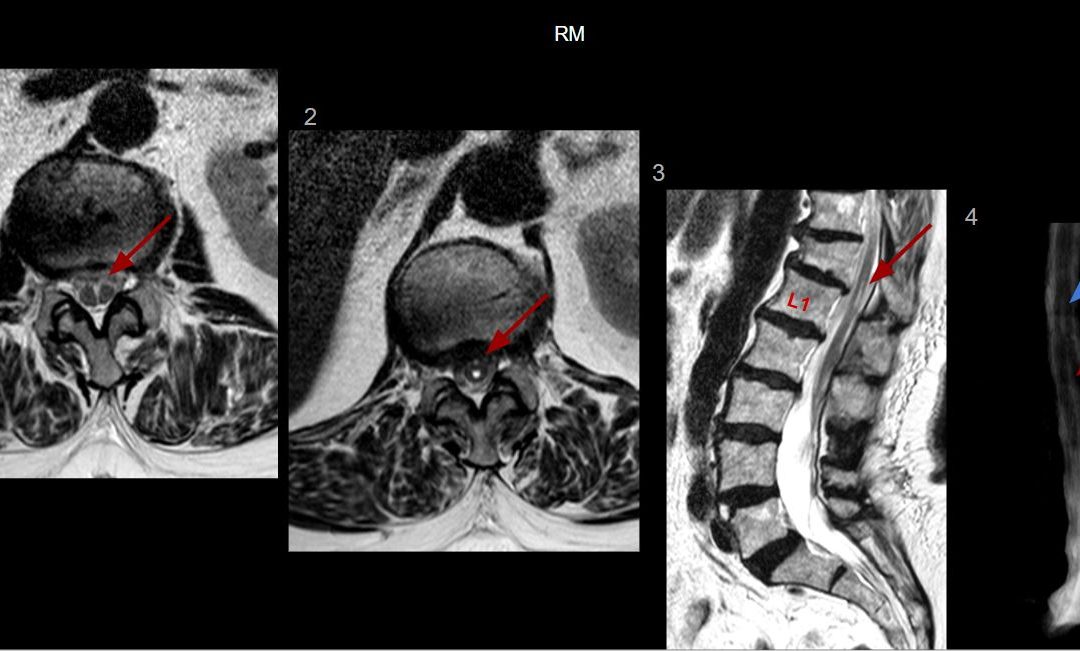
Imágenes de Resonancia magnética.
1. Axial T2 a la altura de L2: se evidencia una hendidura en la región central del cordón medular, que se extiende desde L1 hasta L3, existiendo dos hemimédulas contenidas en un único saco dural (Flecha roja).
2. Axial T2 a la altura de T12-L1: cranealmente a la hendidura medular previamente descrita, hay una dilatación del epéndimo compatible con hidromielia. (Flecha roja)
3. Sagital T2: el cono medular se sitúa a la altura de L3, y se identifica la hidromielia T12-L1 (Flecha roja). Además, hay un hundimiento crónico del platillo superior de T12 e incipiente espondilolumboartrosis.
4. Mieloresonancia: se visualiza la hendidura central en el cordón a la altura de L1-L3 con dos hemimédulas (flecha roja) y superiormente se identifica la hidromielia (flecha azul).
Diagnóstico
DIAGNÓSTICO
Diastematomielia tipo II .
-Discusión: La diastematomielia (del lat. tardío diastēma ‘intervalo’, y este del gr. διάστημα) es una malformación congénita englobada dento de los disrafismos espinales en la que se divide el cordón medular en dos mitades separadas entre sí por un tabique fibroso, cartilaginoso u óseo. La localización más frecuente está entre T9 y S1. La división del cordón medular puede ser completa (mayor frecuencia), o parcial, afectando únicamente a la cara anterior o posterior.
Las dos hemimédulas suelen ser simétricas, y la longitud es variable. Hay dos tipos:
-Tipo I: hay dos sacos tecales con su respectivo recubrimiento de duramadre para cada hemimédula, separados por un espolón en la línea media (óseo u osteocartilaginoso). Suele asociarse con médula anclada, espina bífida, alteraciones cutáneas y anomalías vertebrales (hemivértebras, vértebras en mariposa, entre otros).
-Tipo II: saco dural único, con tabique fibroso o fibrovascular no rígido en la línea media. Puede haber espina bífida, y otras anomalías vertebrales son mucho menos comunes, pudiendo asociarse con escoliosis.
La hidromielia es un hallazgo frecuente en ambos tipos.
-Imágenes:
Ecografía prenatal: bifurcación del cordón medular en dos hemimédulas en la exploración en plano transversal.
TC: puede identificar el tabique óseo.
RM: técnica de elección para identificar la división medular y su arquitectura, siendo evidenciable el tabique dependiendo su composición y grosor., y permite valorar otras malformaciones asociadas. La hidromielia se visualiza como un área de señal líquida centromedular.
-Diagnóstico diferencial:
La diplomielia: la médula está duplicada, hay dos hemimédulas completas, con sus astas anteriores y posteriores, extremadamente rara y discutida. Algunos autores lo consideran dentro del mismo espectro que la diastematomielia, englobando las diferentes entidades en el llamado síndrome de la “médula espinal hendida”.
-Clínica y tratamiento: En el tipo I la mayoría de los pacientes son sintomáticos y presentan signos y síntomas de médula anclada; el tipo II suele ser oligosintomático o asintomático. El tratamiento es quirúrgico en la infancia, con escisión del espolón óseo y reparación de la duramadre. En adultos y en casos asintomáticos no se suele realizar cirugía.
Evolución del caso: La paciente recibió tratamiento fisioterapéutico y analgésico dirigido a su espondiloartropatía degenerativa.
Bibliografía:
1- Rufener SL, Ibrahim M, Raybaud CA, Parmar HA. Congenital spine and spinal cord malformations–pictorial review. AJR Am J Roentgenol. 2010 Mar;194(3 Suppl):S26-37. doi: 10.2214/AJR.07.7141. PMID: 20173174.
2- Pang D, Dias MS, Ahab-Barmada M. Split cord malformation: Part I: A unified theory of embryogenesis for double spinal cord malformations. Neurosurgery. 1992 Sep;31(3):451-80. doi: 10.1227/00006123-199209000-
3- Albulescu D, Albu C, Constantin C, Stoica Z, Nicolescu I. Diastematomyelia – Imaging Findings, Case Report. Curr Health Sci J. 2016 Jan-Mar;42(1):94-96. doi: 10.12865/CHSJ.42.01.13. Epub 2016 Mar 29. PMID: 30568818; PMCID: PMC6256142.